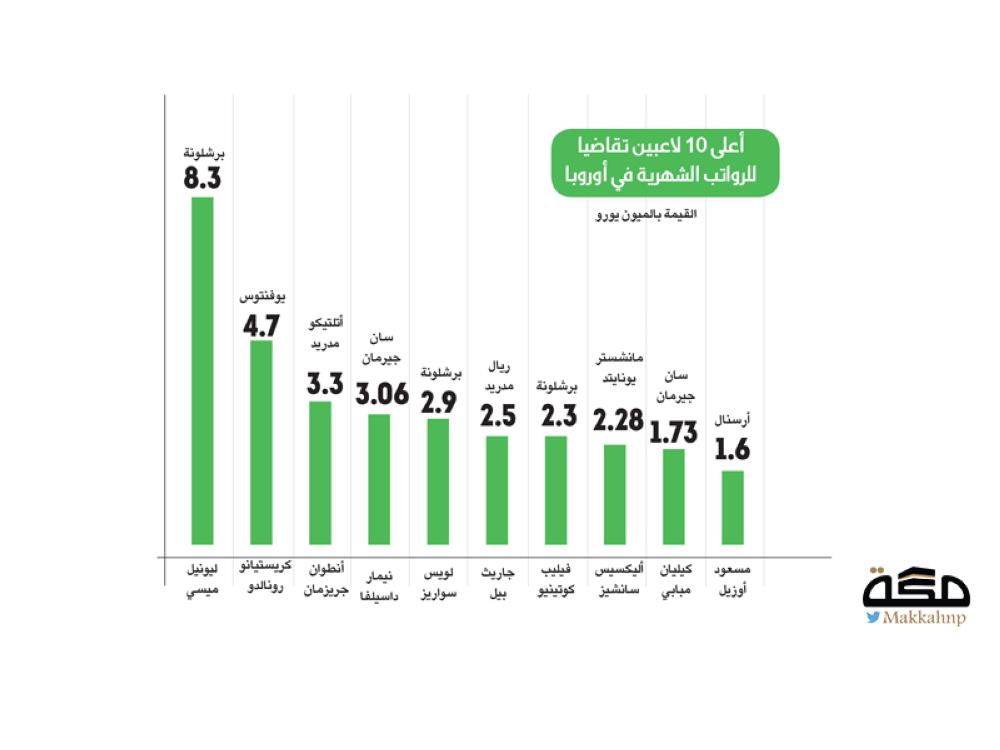
استخدم العلماء طيف ذرة الهيدروجين للتعرف على مكونات الذرة - 1
Recent Posts
- أي الكسور التالية يُعَد كسرا عشريا دوريا؟ . . . .
- بلاك بورد جامعة الملك سعود
- باقة ورد صغيرة
- وثيقه عمل حر
- كم عمر الملك فيصل
- المركز الثقافي المصري بالرياض
- Aramex customer care number
- من اعراف الكتابة الاساسية
- قاد ابراهيم باشا القوات العثمانية في حصار الدرعية
- Anime news network
- ترتيب الهلال في اسيا
- ضريبة القيمة المضافة 15
- فياض باب الحارة
- ايفون 13برو ماكس
- ابتكر المسلمون منهج التأليف حسب الطبقات وهومرتبط بعلم الفقه
- فتح حساب في بنك الاهلي
- وظائف وزارة الدفاع
- بريمير لاونج
- فهد بن حثلين تويتر
- Dune part 2
التفكير الإيجابي والسلبي
يتمركز في فضاء، الذي رغم كل شيء يبقى محدود في: 3a، احتمال وجود الإلكترون صغير جدا نتكلم عن مدار كروي ، عادة في ، ينبغي أن نرسم خط وسيط للمساحة التي تشمل ما يقرب من 98٪ من احتمال العثور على الإلكترون فيها.
الذرة، بما تحمله من خصائص؛ عدد بروتوناتها، كتلتها، توزيعها الإلكتروني.
الخطوط الطيفية لذرة الهيدروجين تتشكل الخيوط الطيفية لذرة الهيدروجين عند امتصاص الذرة كميّة من الطاقة، فيُساهم ذلك في انتقال الإلكترون من مداره نحو مدار أبعد، ويُحدد المدار الذي ينتقل إليه اعتمادًا على كميّة الطاقة التي يكتسبها، والتي تساوي الفرق في الطاقة بين مستويات الطاقة لها؛ إذ كلما زادت الطاقة، يُصبح التباعد بين المستويات أقل، حيث وضح ذلك نموذج بور بأنّ المسافة بين المدارات غير متساوية، والتغيّر الحاصل في الطاقة بين المستويات لذرة الهيدروجين يولّد ضوء له تردد معين، وأثبت بور بأنّ طيف الانبعاث لذرة الهيدروجين يتكوّن من 4 ترددات مختلفة، واعتمادًا على الأطوال الموجيّة لهذه الترددات استطاع بور حساب الطاقة التي يمتلكها إلكترون ذرة الهيدروجين في كل مستوى طاقة ينتقل إليه.
خطوط طيف الهيدروجين
و هما يعتبران جسم نقطي.
ذ ، حيث تساوي كتلة البروتون 1 و.
.
- Related articles
2022 deregimezmoi.fr